HOME
自从1868年Langerhans第一次描述了皮肤存在的树突状细胞以来,人类就开始了漫长的探索树突状细胞的功能的征程。1973年Steinman和Cohn确认了小鼠脾脏中的树突状细胞,并用一系列实验证明了淋巴组织源性的树突状细胞是强有力的初始免疫反应的激发者。随后有学者发现类似的细胞在非淋巴组织中也存在,它们都在心脏和肾脏移植的排斥反应中起着重要的作用,这进一步激发了人们研究树突状细胞的兴趣。然而由于树突状细胞标记物的不足,很难把它从单核细胞或巨噬细胞中分离,在树突状细胞的纯化问题上科学家举步唯艰。但还是有几个实验中心坚持不懈直至得出这样的结论:树突状细胞是一个专职的递呈抗原,并能激发初始(和二次)T细胞免疫反应的白细胞群体。
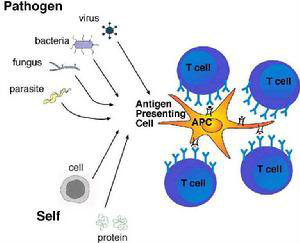
1.DC的来源与特点
目前一致认为 ,具有典型树突状形态、膜表面高表达MHCⅡ类分子、能移行至淋巴器官和刺激初始型T细胞增殖活化,并具有一些相对特异性表面标志的一类细胞,方能称之为DC。 髓系来源的DC与淋巴系干细胞来源的胸腺内DC的功能特点有所不同。大多数DC来源于骨髓,在小鼠、大鼠、人的骨髓中均含有MHCⅡ类分子阴性的前体细胞 ,在体外培养中能生成具有典型形态、表型及功能的 DC。DC广泛分布于除脑以外的全身各脏器 ,数量极微,仅占PBMC的 1% 以下 ,占小鼠脾脏0.2% ~0.5%。DC前体细胞由骨髓进入外周血 ,再分布到全身各组织。从外周血中分离到DC前体细胞 ,可分为二类 ,一类是CD34+ CLA+(皮肤淋巴细胞相关抗原) ,一类是 CD34+ CLA- ,二者均可在体外由 GM-CSF+TNF-α培养生成DC,但仅前者可生成具有Bribeck颗粒的LC,因而表明在发育早期DC的系统发育定向已被确定 ,其它脏器 DC是否有类似情况尚无报道。在体外单细胞培养体系中,人CD34+干细胞加入GM-CSF+TNF-α后 ,可以出现含有粒细胞、巨噬细胞、DC三系细胞的克隆 ,因而一般认为这三类细胞具有共同的前体来源;而在体外甲基纤维素半固体培养体系中发现 , GM-CSF+TN F-α可以诱生出两类克隆,一是典型的GM -CFU克隆,含有粒细胞、巨噬细胞及少量DC,而另一类型的克隆则几乎全由 DC组成 ,即有DC-CFU的存在,因而表明机体内存在独立的DC系。
2 DC与慢性肝脏疾病
2.1 DC与病毒性肝炎
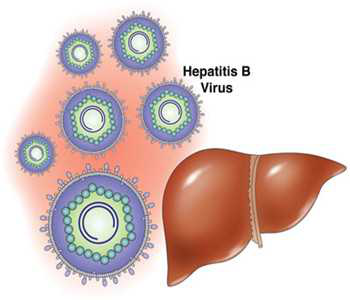
DC与乙型肝炎病毒( hepatitis B virus,HBV) HBV是一种嗜肝性的、非直接致细胞病变的DNA病毒,可以引起急性和慢性肝炎。DC对HBV抗原的识别机制有3种: ①DC可通过Toll样受体9识别HBV DNA,Toll样受体9可以诱导活化核因子κB及p38丝裂原活化蛋白激酶信号通路,以非依赖干扰素信号形式上调干扰素调节因子7的表达,导致IFN-1和炎性因子的分泌,诱导DC的成熟及促进适应性免疫应答。②DC不能直接识别乙型肝炎核心抗原或乙型肝炎e抗原,但是DC可以通过Toll样受体识别乙型肝炎核心抗原中被质膜包裹的 DNA或者单链RNA。③DC可通过甘露糖受体识别乙型肝炎表面抗原,但甘露糖受体在没有特异性DC细胞间黏附分子-3-结合非整合素分子的辅助下难以诱导DC成熟。以上3种识别机制均可以诱导有效的抗病毒应答。mDC为经典DC,是对与HBV免疫应答中主要的抗原呈递细胞,Toll 样受体2、4识别HBV抗原后,上调 MHC-Ⅱ水平,并可迅速分泌炎性因子尤其是 IL-12,促使CD4+T分化为Th1,参与免疫应答。pDC识别HBV抗原后可产生大量IFN-1,尤其是IFN-α,干扰素的释放启动了瀑布式炎症级联反应,最终导致病毒清除。
研究表明,慢性HBV患者的DC中存在HBV DNA,导致病毒逃避免疫攻击,机体形成慢性感染。近期,体外试验显示,乙型肝炎表面抗原可被循环mDC内化,导致DC的功能缺陷且DC病毒负载量也减少。
在评估乙型肝炎患者的疾病进展方面pDC比mDC敏感,而pDC在感染的早期阶段减少, mDC 在晚期阶段减少。在接受阿德福韦酯的治疗后,外周血中mDC数目增多是治疗有效反应的标志; 与健康对照组比较,CD80和 CD86在乙型肝炎患者中的数量显著减少,说明慢性乙型肝炎感染可导致DC功能降低和T细胞活性受抑制。
DC与丙型肝炎病毒(hepatitis C virus,HCV)研究发现,持续性HCV感染患者MHC-Ⅰ类(CD8+)和MHC-Ⅱ类( CD4+)限制性T 细胞的增殖反应降低,多种因素可导致这种结果,如Treg的诱导和DC功能的损害。越来越多的证据证明,循环中mDC和pDC水平的降低是HCV感染独特的标志。此外,循环DC数量与丙氨酸转氨酶水平及肝脏疾病严重程度有关。
Leone等研究报道,HCV持续感染的患者循环中mDC及pDC的细胞数量低于健康对照组和自发性清除HCV感染者。但是提取HCV持续感染患者的DC,在体外刺激成熟,DC表现出的抗原摄取能力、共刺激分子的表达能力及细胞因子的生成量均是正常的。相比之下,它们在刺激成熟后并没有展现出从免疫蛋白酶体到标准蛋白酶体亚基表达的巨大转换,也没有表现出抗原肽相关转运蛋白体的上调。也就是说,DC中蛋白酶体降解抗原功能的失调,使其对T细胞活化能力降低,导致免疫耐受。
另有研究显示,慢性HCV感染者循环DC数目减少,但在肝脏中DC数目是增加的,且肝脏 mDC/pDC高于循环血,循环DC的减少更可能是由于它们迁移到肝脏炎症区域,提示mDC优先迁移。这一发现可被理解为慢性HCV感染者、DC主动交换和肝内外分布不平衡是导致循环DC减少的关键原因。
2.2 DC和肝纤维化
肝纤维化是各种病因引起的慢性肝损伤的肝脏瘢痕反应,是肝脏中常见的生理反应,是肝硬化的早期阶段,具有可逆性。损伤后细胞外基质( extracellularmatrixc,ECM)的沉积导致肝细胞重构,最终导致肝硬化。ECM主要成分是胶原蛋白、蛋白聚糖、层粘连蛋白、纤维连结蛋白等,肝星状细胞是ECM的主要来源。肝星状细胞的激活是肝纤维化的重要环节,同时各种炎性细胞及其炎性因子在纤维化中也起关键作用。此外,DC可能通过肿瘤坏死因子α调节炎症环境来调控肝纤维化的发生,并可调控多种纤维化生成细胞的数量及活性,因此可以间接调控肝纤维化。
另有研究表明,肝脏纤维化还涉及ECM重构。基质金属蛋白酶是一种重要的钙依赖性蛋白酶,该酶可降解ECM的胶原与非胶原成分,DC参与了分泌基质金属蛋白酶,可降解ECM使组织结构疏松,导致DC的肝外迁移,DC的迁移有助于其适应性免疫应答反应的表达。
DC与慢性肝脏疾病的发生、进展息息相关。对DC的生物学特点及效应的深入研究为治疗性 DC疫苗的发展策略打开了新渠道。以DC为代表的细胞免疫治疗能恢复免疫功能和调节免疫失衡,可有效清除手术、放化疗后残余的癌细胞及微小病灶,预防肿瘤的复发和转移,可弥补手术、放疗及化疗等传统疗法的弊端。显而易见,致力于治疗性DC疫苗的研究令人振奋,其在慢性肝病治疗方面具有广阔的临床应用前景。